现在的位置:主页 > 综合新闻 >
磷酸位点基因组编辑的终极目标之--发展基因组药(2)
【作者】:网站采编【关键词】:【摘要】:使用CRISPR/Cas9技术,基因组的编辑变得简单,因此可以在体内和体外更有效地制备和分析磷酸化位点的“敲入”点突变。 案例分析1: 使用CRISPR系统研究单
案例分析1:
使用CRISPR系统研究单基因肝病
威尔逊氏病(Wilson's disease, WD)作为单基因肝病是基于ATP7B基因的突变而产生的,并导致肝脏中铜(Cu)排泄的功能恶化。过量的铜积累在各种器官,例如肝脏和大脑。威尔逊氏病患者表现出临床异质性,涵盖了从急性或慢性肝衰竭到神经系统症状。通过锌或螯合剂的终生治疗可以改善病程,但是在相当一部分患者中观察到严重的副作用,例如神经功能恶化和肾毒性,因此肝移植将是不可避免的。另一种治疗方案则是ATP7B基因的基因校正。在这项研究中,研究人员使用CRISPR/Cas9基因编辑在人类细胞系中引入人工ATP7B点突变,并通过额外使用的单链寡核苷酸(ssODNs)来纠正这一突变,模拟威尔逊氏病点突变在体外的基因修正。
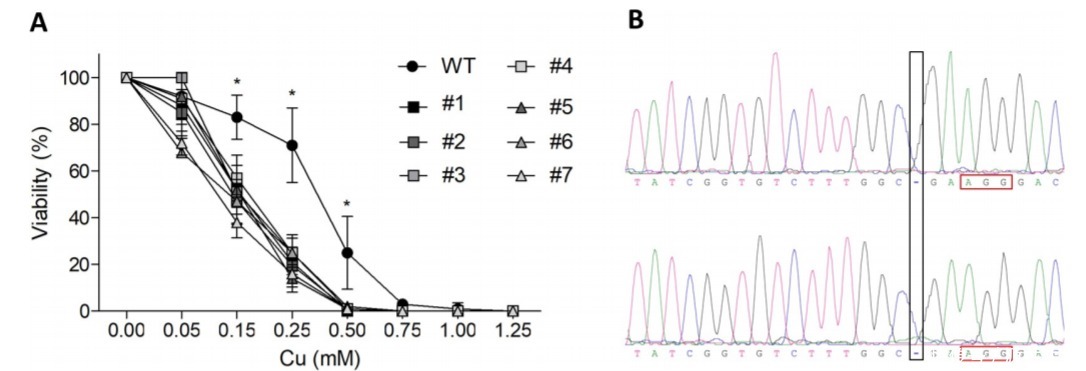
图一:ATP7B基因敲除突变体的生成
CRISPR/Cas9介导的ATP7B-KO细胞产生了铜电阻降低。用HEK239T细胞建立敲除模型并用PX459脂质体转染。用MTT法测定HEK293T细胞和KO突变体(图1A)的细胞代谢活性。Sanger测序证实HEK293T细胞克隆#1在1184位置(黑色框内标记)缺失一个胞嘧啶核苷酸,且PAM区域上游有三个核苷酸(红色框内标记)。
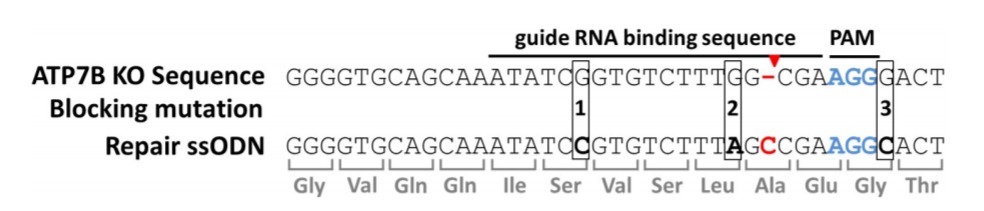
图2:CRISPR/Cas9介导的ATP7B修复方案
ATP7B敲除细胞(HEK293TΔC)表现为胞嘧啶核苷酸缺失(红色“-”标记)的点突变。Cas9在PAM区域(标蓝)上游切断三个核苷酸(红色箭头标记)。修复ssODN在位置1、2和3(ssODN_3M)或位置2和3(ssODN_2M)包含沉默阻断突变。
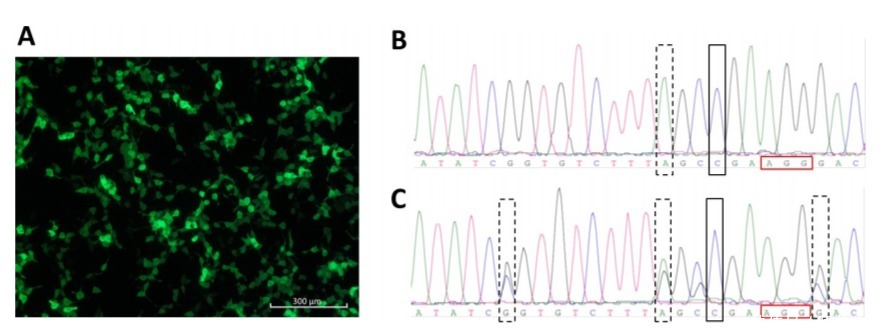
图3:CRISPR/Cas9介导的ATP7B修复方案
用pmaxGFP脂质转染HEK293TΔC细胞。GFP表达水平显示在图3A中。对携带阻断突变2号(虚线框)的ATP7B修复的纯合HEK293TΔC细胞克隆(黑色框)(图3B)和携带所有三个阻断突变(虚线框)的ATP7B修复的杂合HEK293TΔC细胞克隆(黑色框)(图3C)进行Sanger序列分析。这些实验数据证明了CRISPR/Cas9介导的ATP7B点突变校正是可行的,并且有发展临床使用的可能。
案例分析2:
使用CRISPR/Cas9校正HCT-116细胞中的β-cateninΔTCTser45的缺失突变
结直肠癌是第三大常见癌症。CRC与Wnt/β-catenin(β-连环蛋白)信号传导通路的失调密切相关。β-catenin在Ser45被酪蛋白激酶1(CK1)磷酸化,并连续在Ser33,Ser37和Thr41被糖原合酶激酶-3β(GSK-3β)磷酸化,从而引起随后的泛素化和蛋白酶体降解。这些Ser/Thr残基的突变会改变重要的功能性磷酸化位点,抑制β-catenin磷酸化降解级联反应,并导致Wnt/β-catenin信号通路的组成性激活。因此,通过基因编辑技术校正β-catenin基因突变可以开发用于结肠癌的新一代治疗方法。
在该研究中,人结肠直肠细胞系HCT-116被选用,因为它具有β-catenin基因的杂合缺失突变(ΔTCT),其负责在蛋白质的N-末端区域编码调节性Ser45。研究人员通过基因测序证实了ΔTCTSer45缺失突变在β-连环蛋白基因的外显子3和CRISPR/Cas9 PAM位点上的位置。96 nt ssODN包含了作为HDR修复模板的野生型β-catenin基因序列。将HCT-116细胞与载体和ssODN共转染后,通过FACS筛选GFP阳性细胞并扩增,并通过TA克隆和测序计算突变校正效率。
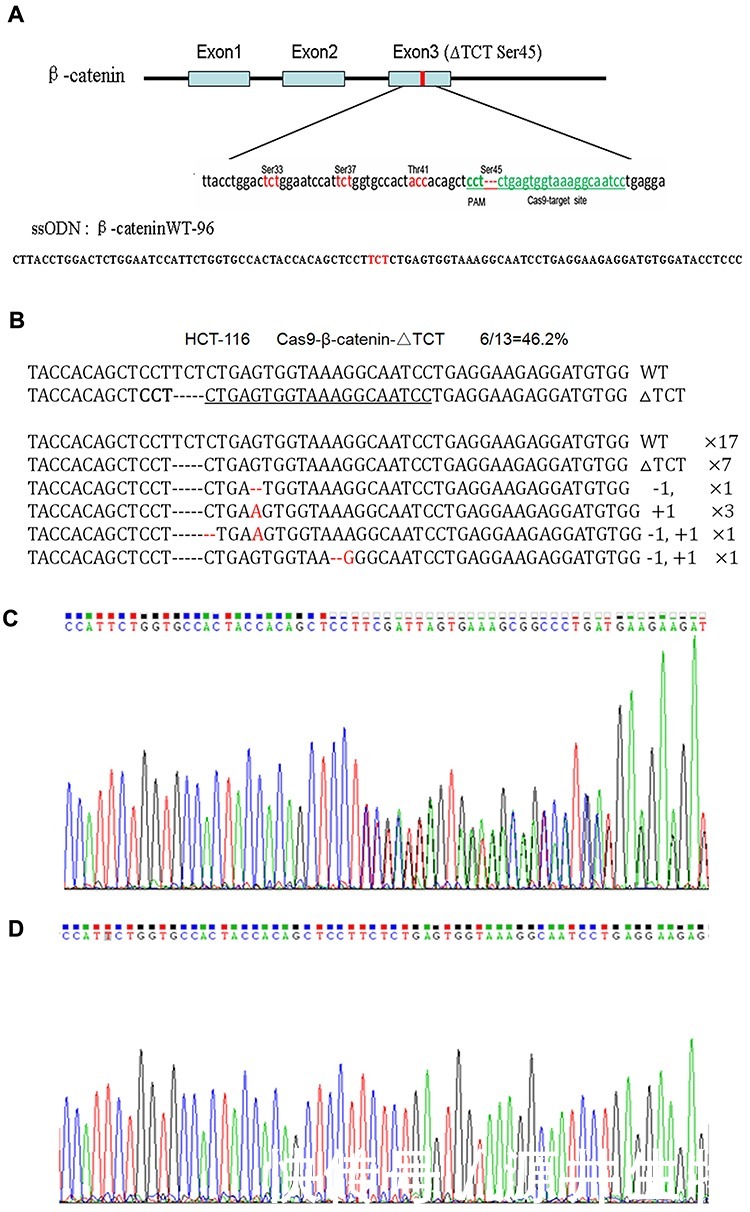
图1:HCT-116细胞中β-cateninΔTCTser45的突变校正
由于该基因的一个等位基因中的缺失突变,HCT-116细胞中β-catenin的测序图谱显示从突变基因座开始的重叠峰(图1C)。突变校正后,我们发现突变基因座中存在TCT序列,因此从突变基因座开始的重叠峰也相应消失了(图1D)。这些发现证实,用Cas9-GFP/sgRNA共表达载体和ssODN共转染可以纠正HCT-116细胞中的β-cateninΔTCTser45缺失突变。
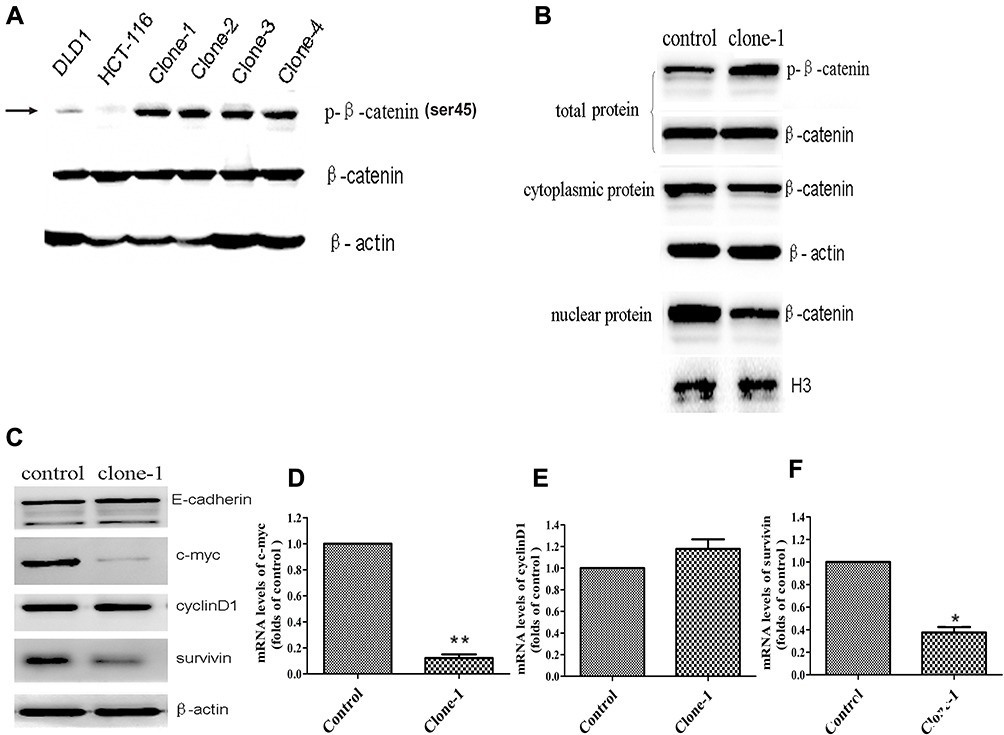
图2:β-cateninΔTCTser45突变校正的功能作用
β-catenin的Ser45是重要的磷酸化位点。ΔTCT密码子的缺失突变将对HCT-116细胞中的β-cateninSer45磷酸化产生巨大影响。因此,研究人员研究了缺失突变体和被校正突变体中β-catenin的表达水平。如预期的那样,与没有β-cateninΔTCT缺失突变的DLD1大肠癌细胞相比,未校正的HCT-116细胞具有非常弱的可检测Ser45磷酸化β-catenin表达(图2A)。他们还研究了对照组和一个突变校正的HCT-116细胞克隆中的蛋白质表达,即总体、核和细胞质的β-catenin水平(图2B)。此外,他们还比较了蛋白质的表达以及E-cadherin(E-钙粘蛋白),c-myc,cyclinD1和survivin基因(图2C,D,E和F)。
文章来源:《肿瘤药学》 网址: http://www.zlyxzz.cn/zonghexinwen/2021/0708/1440.html
上一篇:合理用药如何践行?药学队伍、药品配备待优化
下一篇:跨越千年的人与药学之“恋”

